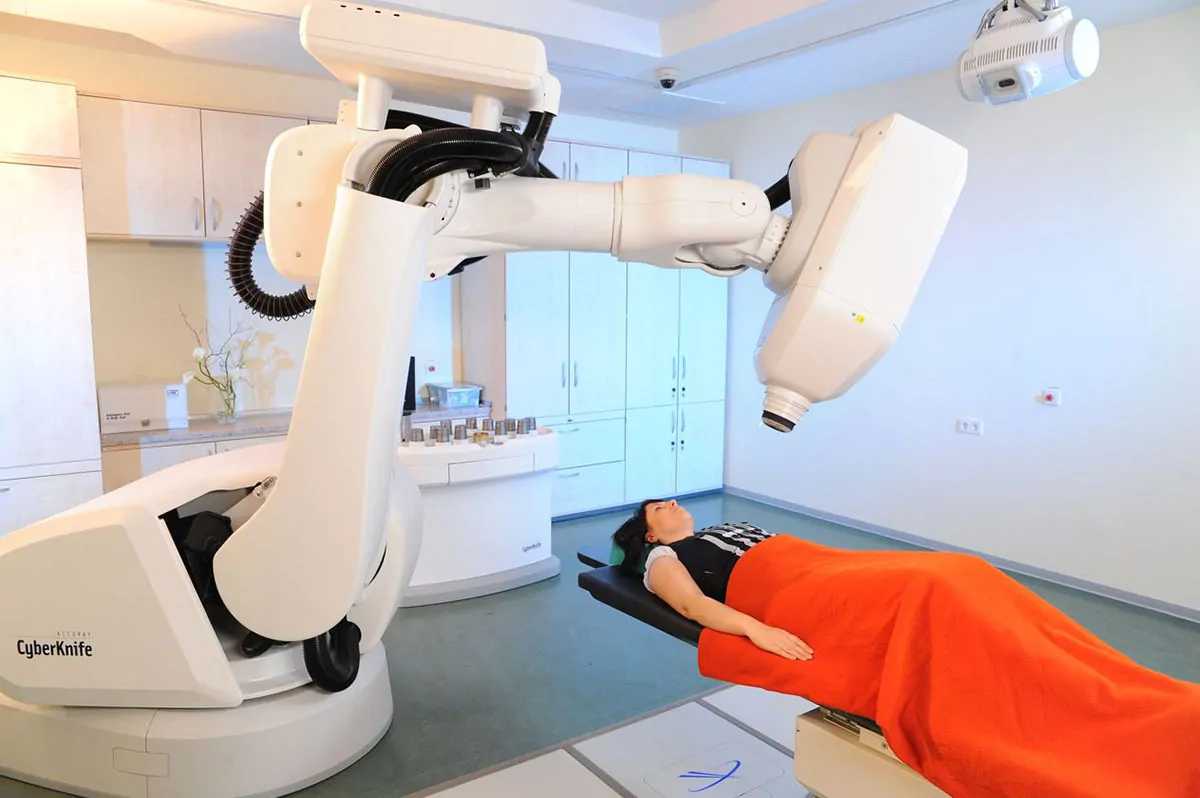
Das robotergestützte CyberKnife
Das CyberKnife garantiert eine der modernsten Therapien für viele Tumorarten bei höchstem Patientenkomfort. Durch die hoch entwickelte digitale Bildführung und die Robotersteuerung können hohe Strahlendosen mit einer Genauigkeit von Millimeterbruchteilen gebündelt werden. So wird eine minimale Belastung gesunder Organe bei maximaler Effektivität gewährleistet. Als einziges System weltweit ist das CyberKnife in der Lage, atmungsbedingte Bewegungen im Körper auszugleichen. Dies ist besonders bei bewegten Tumoren in Lunge und Leber von entscheidendem Vorteil. Unser Team und unsere Partner sind seit Jahren führend in der Entwicklung des CyberKnife tätig. Unsere Expertise ist dadurch weltweit einmalig und unsere Behandlungsergebnisse sprechen für sich.
Innovative Entwicklungen aus Deutschland
Seit den Anfängen der robotergestützten Radiochirurgie ist das Institut für Robotik und Kognitive Systeme der Universität zu Lübeck enger Bestandteil der innovativen CyberKnife-Entwicklungen mit modernsten Soft- und Hardware-Technologien. Wichtige Bereiche sind Robotersteuerung, Bestrahlungsplanung sowie Vorhersage und Kompensation von Bewegungen. Viele Komponenten des CyberKnife wurden von unserem Team und Kooperationspartnern in Deutschland entwickelt:

Technik und Physik
Das CyberKnife ist hervorragend für intrakranielle Radiochirurgie geeignet, also für Behandlungen innerhalb des Schädels. Diese Technologie ist herkömmlichen Bestrahlungssystemen überlegen – nachgewiesen in zahlreichen technischen und klinischen Studien. Auch bei bewegten Tumoren (z.B. in Lunge und Leber) ist das CyberKnife das präziseste Behandlungssystem mit sehr geringen Unsicherheiten.
Die Saphir Mitarbeiter arbeiten eng mit dem Robotik-Institut und anderen führenden Zentren für Medizinphysik und Technologie zusammen. Damit zählen unsere Radiochirurgie Zentren zu den technisch erfahrensten Behandlungseinrichtungen weltweit. Zudem setzten wir neue Standards in Qualitätssicherung und Bestrahlungsplanung – ein großer Vorteil für unsere Patienten. Zu unserem Forschungs- und Entwicklungsprogramm gehören auch Innovationen, wie z.B. die ultraschallgeführte oder MRT-geführte Radiochirurgie oder die Herzradiochirurgie, die Ende 2018 zum ersten Mal in einem Patienten in Deutschland Anwendung fand.